發佈時間:13:02 2024-04-01

美國食品藥物管理局(FDA)最近對醫療器械公司Abiomed旗下的Impella心臟泵系列進行了最嚴重級別的召回。根據FDA的資料,這些心臟泵的血泵導管存在刺穿左心室壁的風險,已經在美國導致了129人重傷和49人死亡。衛生署回應查詢時表示,其中一款心臟泵在香港的13家公立醫院和2家私立醫院使用,但到目前為止,尚未接到任何相關的醫療事件報告。
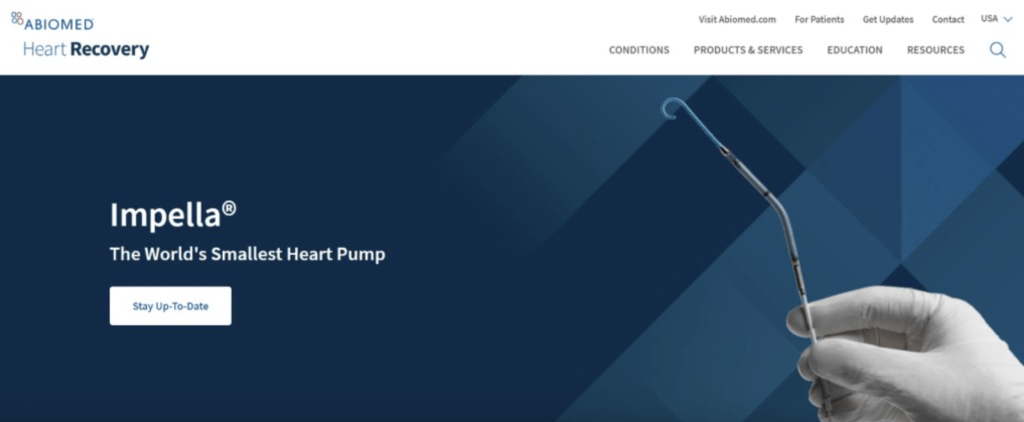
衛生署指出,早在2月15日,當FDA在其網站上公布有關Impella產品的安全警示時,衛生署已經通過其監察機制得知並立即跟進。這個安全警示涉及到6款左心室輔助裝置,其中Impella 2.5和Impella CP是在衛生署的醫療儀器管理制度下列出的醫療儀器。
根據Impella在香港的負責人提供的資料,只有Impella CP提供給了香港的13家公立醫院和2家私立醫院,其他5款產品並沒有進入香港市場。從2023年到2024年3月22日,共供應了374部Impella CP給上述醫院,並已通知相關的修正措施;製造商也正在逐步更新受影響裝置的使用說明書。
衛生署表示,在這起事件中,其下屬的醫療儀器科已經在2月15日和2月26日在其網站上刊登了相關的安全警示。
醫管局在回應查詢時表示,對這一事件非常關注,已經立即檢視和評估了有關儀器的臨床使用情況,並提醒醫護人員嚴格遵守儀器的使用指引,並加強對相關風險的注意。
醫管局指出,自2018年起,他們引入了這款心室輔助器,用於治療特定臨床需要的心臟病患者。目前,醫管局所轄的公立醫院每年為100多名病人進行相關治療,並且迄今為止沒有出現FDA在警告中提到的不良事件。
醫管局強調,供應商已經發出了關於這一情況的更正通知,並再次提醒醫護人員嚴格執行使用儀器的正確程序和指引,包括在手術過程中小心定位導管,通過超聲波掃描確定導管位置的正確性,以及在為高風險患者置入導管時需加倍謹慎等。醫管局將繼續密切關注相關監管機構和儀器供應商的最新公告,並密切監察有關儀器的臨床使用情況。